.
.
.
Así se comporta el cerebro durante un ‘viaje’ psicodélico
La psilocibina, una sustancia alucinógena con potencial terapéutico en psiquiatría, altera una red cerebral involucrada en el pensamiento introspectivo que nos lleva a soñar despiertos y a recordar
.
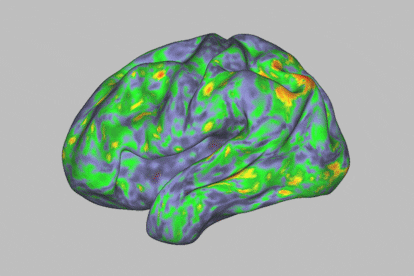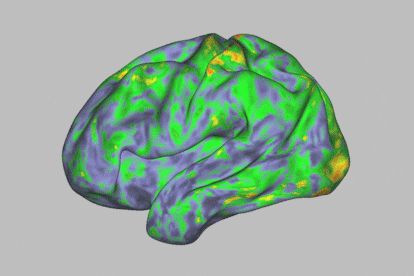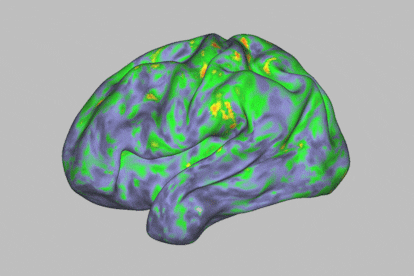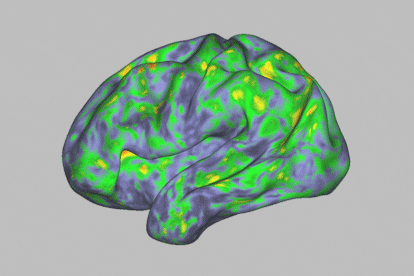
Mapa de calor de los patrones de actividad cerebral que muestra una profunda alteración durante la experiencia de un individuo después de tomar psilocibina.Sara Moser / Washington University School of Medicine
.
A simple vista, en un viaje psicodélico con psilocibina uno se sumerge en una especie de trance: esta sustancia, que está presente en algunos hongos alucinógenos, aboca a un estado alterado de la consciencia, con mucha más sensibilidad al entorno y capacidad de experimentar alteraciones visuales, fenómenos de sinestesia y hasta vivencias místicas. El yo se disuelve, trasciende al cuerpo y se distorsionan las dimensiones espaciotemporales en las que uno se sitúa en el mundo.
.
Todo eso ocurre a la vez, en un lapso temporal de unas cuatro o seis horas, que abre también la puerta a explotar esta travesía con fines terapéuticos: a esta sustancia psicoactiva se le atribuye potencial contra algunos trastornos psiquiátricos, como la depresión resistente o las adicciones.
.
En pleno renacimiento de la medicina psicodélica, la ciencia se ha volcado en estudiar qué hay detrás de estas insólitas experiencias mentales a las que empujan los alucinógenos. Una investigación publicada en la revista Nature ha dado un salto para entender cómo funciona el cerebro en estas circunstancias y ha descrito los cambios cerebrales que se producen, en un puñado de personas sanas, durante estos trances. El estudio alumbra una explicación neurobiológica a esos llamados viajes y revela que la psilocibina altera una red cerebral implicada en el pensamiento introspectivo, como soñar despierto y recordar.
.
.
Investigadores de la Universidad de Washington en Saint Louis (Estados Unidos) monitorizaron la actividad cerebral de siete individuos sanos a los que les administraron dosis altas o de psilocibina o de metilfenidato —unas anfetaminas indicadas para tratar el déficit de atención e hiperactividad—.
.
La idea de comparar estas dos sustancias, explican los expertos consultados, era sortear la sugestión y las expectativas: “En ensayos clínicos con este tipo de sustancias, la persona ya tiene expectativas de que algo le va a pasar y si no nota nada, el cerebro también reacciona. Se dan estimulantes, como el metilfenidato, porque también producen una activación muy parecida a la de la psilocibina, aunque no tiene efectos psicodélicos. Así se evita la sugestión”, cuenta Víctor Pérez, jefe de Psiquiatría del Hospital del Mar de Barcelona.
.
El médico no ha participado en este estudio, pero conoce bien este compuesto y ha colaborado en otras investigaciones con psilocibina para tratar la depresión.
.
Para conectar las experiencias subjetivas de estos trances con una explicación neurobiológica, los investigadores sometieron a todos los participantes a pruebas de neuroimagen antes, durante y después de la toma.
.
“Hoy en día, sabemos mucho sobre los efectos psicológicos y moleculares o celulares de la psilocibina. Pero no sabemos tanto sobre lo que sucede en el nivel que conecta los dos: las redes cerebrales funcionales”, justificaba en un comunicado Joshua S. Sieger, primer autor del estudio.
.
El cerebro humano está compuesto por 100.000 millones de neuronas conectadas entre sí y dispuestas a su vez en intricadas redes que sincronizan su actividad para construir pensamientos, comportamientos y emociones.
.
El análisis de los científicos reveló que la psilocibina alteró de forma masiva la conectividad funcional —la comunicación entre distintas áreas cerebrales— en la corteza y la subcorteza del cerebro, provocando cambios mucho más agudos de los que generaba el metilfenidato.
.

Un investigador sostiene una microdosis de psilocibina.microgen (Getty Images)
.
.
En concreto, los cambios más profundos se veían en la red neuronal por defecto, un conjunto de regiones cerebrales asociado a los automatismos, a las actividades que se hacen cuando la mente está en reposo. “Es una zona relacionada con el sustrato de nuestra identidad, con nuestro ego”, cuenta Óscar Soto, psiquiatra y presidente de la Sociedad Española de Medicina Psicodélica. Esta área suele estar alterada en algunos trastornos psiquiátricos.
El estudio reveló que, durante el viaje psicodélico, se alteran de forma generalizada los patrones habituales de comunicación neuronal en todo el cerebro. Pero los cambios más agudos están impulsados por una especie de desincronización en la red por defecto, entre neuronas que habitualmente se activan unas a otras. “Después de que una persona toma la psilocibina, algunas de sus redes cerebrales se disuelven, especialmente la involucrada en la percepción de uno mismo, el espacio y el tiempo. Los cambios en las conexiones a esta red pueden durar semanas”, resume Petros P. Peridis, profesor del Departamento de Psiquiatría de la Universidad de Nueva York, en un análisis adjunto en Nature.
Además, los cambios en la comunicación neuronal de todo el cerebro se correlacionaron con la intensidad de la experiencia psicodélica subjetiva. “La psilocibina es capaz de inducir cambios en la sincronía de la red por defecto y esa desincronización está asociada al efecto psicodélico, pues cuando no tienes esos efectos, no se ven cambios en la red”, explica el psiquiatra del Hospital del Mar.
Después de que una persona toma psilocibina, algunas de sus redes cerebrales se disuelven”Petros P. Peridis, profesor del Departamento de Psiquiatría de la Universidad de Nueva York
Pérez sostiene que, aunque este estudio se ha hecho con participantes sanos y la red cerebral de las personas con un trastorno de salud mental está afectada y el efecto no será el mismo, los datos de este estudio son el “modelo que más se aproxima a lo que pasa en la red neuronal de un enfermo”. Los autores ven cambios en la red neuronal por defecto: se activa cuando das psilocibina y se activa de forma diferente cuando reciben metilfenidato. “Y esto está relacionado con el efecto psicodélico que tiene el paciente, como las alucinaciones, los cambios en el sentimiento del ser, las ideas místicas o el efecto disociativo, en el que el yo se funde con el entorno. Y luego ven que unas semanas después, estos cambios persisten en el hipocampo”, expone.
En los días posteriores a la administración de la psilocibina, la mayoría de redes cerebrales se normalizaron, pero los cambios provocados por la sustancia psicoactiva persistieron en las conexiones entre la red por defecto y el hipocampo anterior, un área involucrada en las emociones y la memoria. En esta zona se guardan los recuerdos asociados a emociones y es de las pocas áreas cerebrales donde hay formación de nuevas neuronas. “Al principio hay un efecto masivo, y cuando desaparece, permanece un efecto puntual. Y eso es exactamente lo que uno quisiera ver en un medicamento potencial. No querrías que las redes cerebrales de las personas quedaran anuladas durante días, pero tampoco querrías que todo volviera a ser como era inmediatamente. Quieres un efecto que dure lo suficiente como para marcar la diferencia”, reflexionaba Nico U. F. Dosenbach, profesor de neurología y coautor del estudio, en un comunicado.
Cambios persistentes
Los investigadores constataron que, en el hipocampo, los cambios se mantenían y había generación de nuevas neuronas; un hallazgo clave, a ojos de Pérez: “Hay un punto de cambio centralizado en el hipocampo, que es una zona que, en pacientes depresivos, se atrofia y desaparece la neurogénesis. De hecho, los fármacos contra la depresión, lo que hacen es activar esa formación de neuronas del hipocampo e impedir que se atrofie. Es muy sugerente pensar que la psilocibina está relacionada con esa neurogénesis [detectada en el estudio]”.
Para Soto, que tampoco ha participado en esta investigación, el estudio “refuerza el paradigma teórico” sobre el que basaban el potencial de este psicodélico. “Y que los cambios persistan a largo plazo es muy relevante porque con administraciones puntuales, conseguimos cambios persistentes”, apunta el psiquiatra, que ejerce en el Parc Sanitari Sant Joan de Déu.
En la misma línea, Petridis considera que el hallazgo tiene “implicaciones clínicas porque sugiere que la psilocibina podría hacer que las conexiones en el cerebro sean más maleables”. Y profundiza en su reflexión: esto “podría ser beneficioso para las personas que experimentan patrones rígidos de pensamiento y comportamiento desadaptativos. Por ejemplo, es concebible que esta maleabilidad pueda usarse para dar a las personas con adicción una nueva perspectiva sobre su relación con las sustancias, o tal vez ayudar a las personas con depresión a escapar de sus cavilaciones”. En depresión resistente ya hay estudios que constatan sus beneficios —incluso Australia permite ya su administración en estos contextos—, pero Soto señala también que ya se está explorando su uso en adicciones (como tabaquismo, alcohol o apuestas), anorexia y trastorno obsesivo-compulsivo.
Puedes seguir a EL PAÍS Salud y Bienestar en Facebook, X e Instagram.
Sobre la firma
Más información
.
.
.
.
.
.
.
.
.


